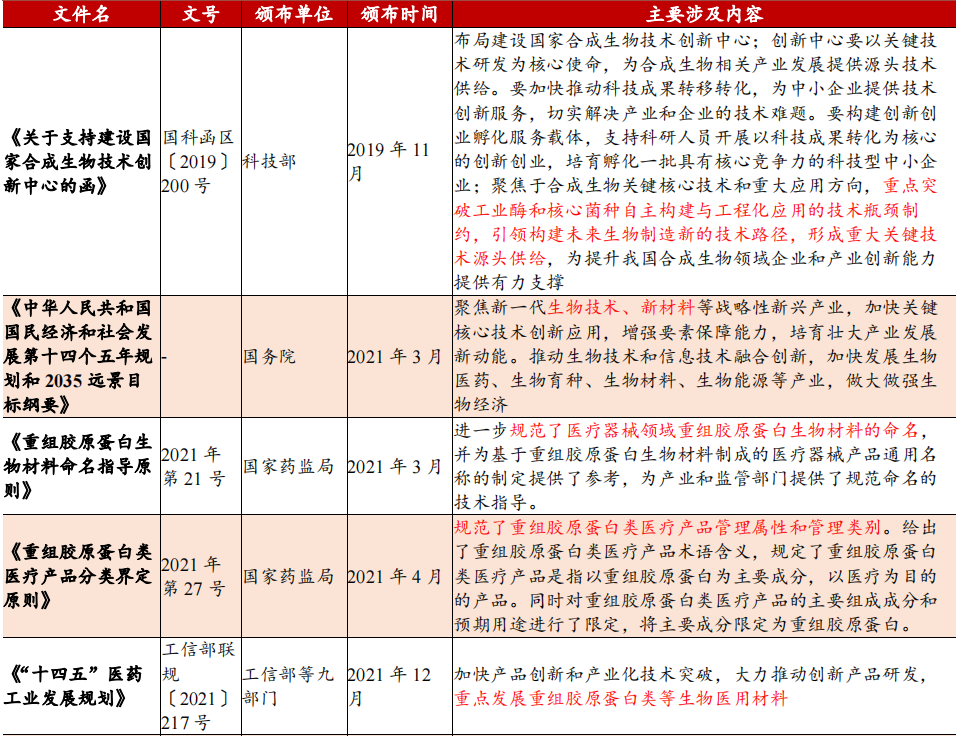
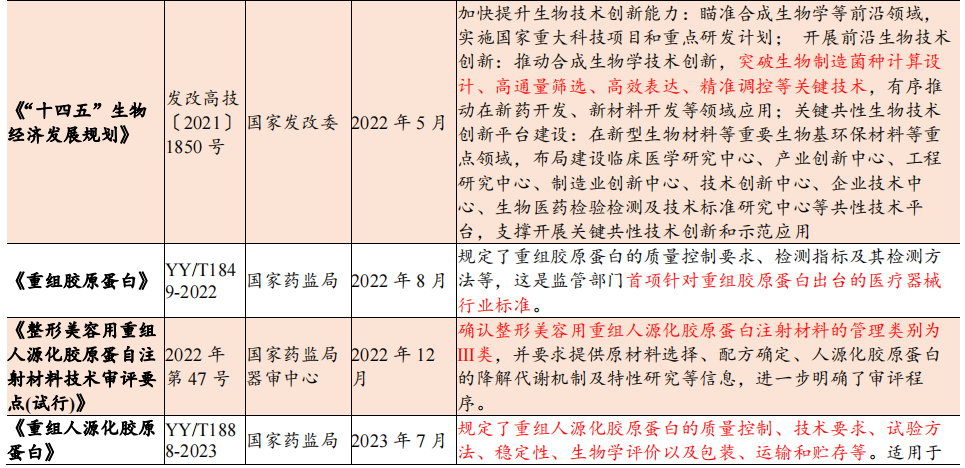
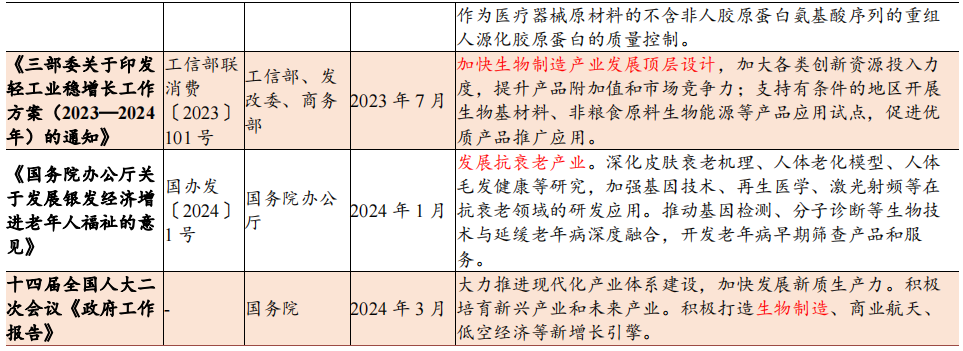
政策支持下重组胶原有序发展
从“十一五”规划以来,我国对生物医药及生物产业的重视程度不断提高,相关规划中对胶原蛋白制备技术发展和应用的描述越来越具体。自2016年以来,国家为促进胶原蛋白等生物产业的发展制定了多条相关规划,内容涉及蛋白技术发展方向、人造蛋白工艺产业化等方面。《“十三五”国家科技创新规划》将合成生物技术列为引领产业变革的颠覆性技术,《“十四五”生物经济发展规划》明确将合成生物学列为重点发展方向,推动发展重组蛋白、人造蛋白等新型食品和药品。
2021年3月,国家药监局发布《重组胶原蛋白生物材料指导原则》(2021年第21号通告),强调I、II、III型别胶原蛋白特征词区分,规定使用重组人胶原蛋白、重组人源胶原蛋白、重组类胶原蛋白等三类A级核心词与溶液、冻干粉、凝胶、海绵、纤维与其他等六类B级核心词。
2021年3月,国家药监局正式建立医疗器械主文档登记制度,优化注册申报流程,极大缩短产品上市时间。同年4月,发布重组胶原蛋白产品医疗器械管理等级不得低于II类,若其中可部分或全部被人体吸收,或用于慢性创面,应按照III类器械管理。
2022年1月及2023年1月国家药监局分别发布YY/T 1849-2022《重组胶原蛋白》和YY/T1888-2023《重组人源化胶原蛋白》行业标准,细化规定了重组胶原蛋白的质量控制要求、检测指标及其检测方法等。2022年12月国家药监局器审中心确认了整形美容用重组人源化胶原蛋白注射材料应为III类,并要求提供原材料选择、配方确定、人源化胶原蛋白的降解代谢机制及特性研究等信息。
需求变化:中国亟需新型医美材料填补高端市场,海外消费偏好于玻尿酸及效果更持久的材料。海外:胶原蛋白医美产品出现早于中国,但是未能引发终端热潮,反而被玻尿酸占据,一方面由于胶原蛋白产品成熟度不够,另一方面由于国内外对于美丽的需求和认知不同。海外填充材料选择多样,除玻尿酸外还有 PLLA/PMMA/CaHA 等材料,动物源胶原蛋白产品力没有明显优势,2003年美国第一款玻尿酸填充剂获批,玻尿酸产品的安全性、有效性(即刻效果更好)、维持时间与价格都更有竞争力,进而胶原蛋白市场逐渐萎缩,进而遏制了海外产业对于重组胶原的研发需求。国内:求美者更注重自然美、安全美,而欧美更注重骨性轮廓美。中国胶原蛋白应用效果逐渐挖掘,眼周等精细化部位效果优于玻尿酸,填补高端医美市场需求,同时美白改善肤质效果精准切入亚洲女性需求。
技术突破:海外胶原蛋白产业起步远早于中国,重组胶原蛋白领域中国优势明显。在国家对于胶原蛋白成分的重视下,巨子生物、锦波生物等一批企业以校企合作方式对于胶原蛋白进行合成生物工业化开发,国外如collplant等公司亦研发重组胶原蛋白,但进度落后于中国。
配套政策:中国出台系列导则标准指导支持重组胶原蛋白产业发展,海外需求萎靡产业规划落后。重组胶原蛋白能够有效克服免疫原性问题与国内产品需求共同推进了我国产业政策的制定和落实,为重组胶原蛋白提供了高速增长的动能。而海外由于胶原蛋白产品市场需求低,发展节奏和产业规划趋缓。