血液制品安全性
血液是人类赖以生存的命脉,血液与血液制品具有医疗产品和药品的双重特性,具有其他药物无法比拟和替代的优点。

血液制品
健康人血浆或经特异免疫的血浆经分离、提纯、经由重组DNA技术制成的血浆蛋白组分以及血液细胞有形成分统称为血液制品。如人血白蛋白、人免疫球蛋白、人凝血因子(天然或重组)。血液制品主要用于治疗和被动免疫预防。
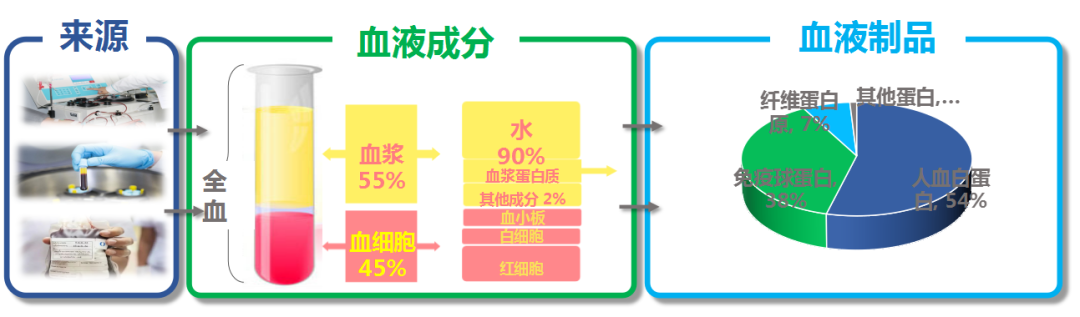
血液制品的生产流程
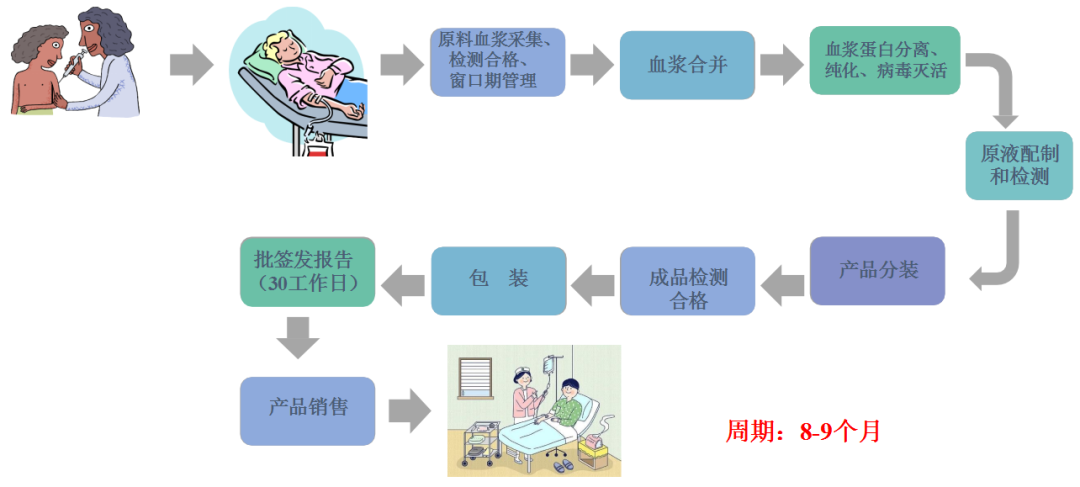
随着生产程序的递进,传播病毒危险逐渐降低
国内血液制品管理相关法规
1996年-国务院发布了《血液制品管理条例》,并于2016年进行了部分修改。此条例对血浆的采集、供应和血液制品的生产经营活动管理进行了规范。条例中规定一个采血浆区域只能设置一个单采血浆站,单采血浆站必须对供血浆者进行健康检查,单采血浆站只能向一个血液制品生产单位供应原料血浆。
2007年-中华人民共和国卫生部发布了《单采血浆站管理办法》,该管理办法对单采血浆站的设置审批、执业、监督管理和相关处罚进行了详细的规定。
2010年-中华人民共和国卫生部颁发了《药品生产质量管理规范(2010年修订)》(中华人民共和国卫生部令第79号),并制定了血液制品附录,对血液制品生产包括从原料血浆接收、入库贮存、复检、血浆分离、血液制品制备、检定到成品入库的全过程进行了详细规定。
2017年-国家食品药品监督管理总局于颁布了《生物制品批签发管理办法》(国家食品药品监督管理总局令第39号),办法中规定血液制品及用于血源筛查的体外诊断试剂在上市前必须经过批签发。
病毒灭活、去除工艺验证
目前,血液制品中常用的灭活/去除病毒方法包括乙醇沉淀、巴氏消毒法、干热法、有机溶剂/去污剂处理法、膜过滤法、低pH孵放法等物理化学方法,分别针对不同的制品,各有其优缺点,详见下表。

一种有效且可靠的病毒灭活/去除方法一般要求经一次病毒灭活/去除处理后,降低病毒滴度≥4log。在实际生产过程中需结合产品特性选取几种方法联合使用,以最大限度地确保血液制品的病毒安全性。
严格的批签发制度血液制品质量得到保证
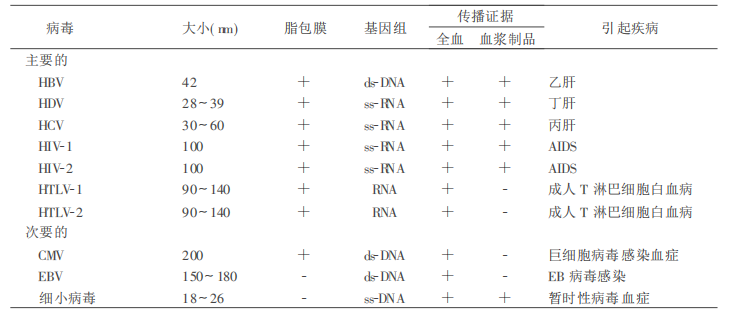
通过血液和血液制品传播的病毒种类很多, 其中HIV、HBV、HCV几种病毒感染率高、危害特别严重。
自1998年GMP实施以后, 血液制品产品质量大幅度提高 。通过2002年人血白蛋白国家批签发结果显示, 共批签发33家血液制品生产企业生产的1361批人血白蛋白全部合格。保证了临床使用的安全性 。
严格的病毒筛查管理保障血液制品质量
我国的血液制品生产用原料血浆采集按照 《中国生物制品规程》“原料血浆采集规程”和国务院颁布的 《血液制品管理条例》要求进行 。
合格的献血员每次献浆在单采血浆站进行HBsAg 、Anti-HCV 、Anti -HIV -12 、 梅毒和丙氨酸氨基转移酶的5项检测, 5项检测合格的血浆储存在合格库 ; 血液制品生产企业在购买合格的原料血浆后再进行以上5项的复检 。
合格的血浆用于生产, 不合格的血浆在药品监督管理部门的监督下销毁 。合格的血浆投料生产每一种血液制品需有相应的 、有效的病毒灭活工艺去除或灭活病毒。
通过建立献血员的标准、实验室的病毒血清学筛查和生产工艺中增加有效的病毒灭活去除工艺, 这三种措施就象三堵防火墙, 使最终生产出来的血液制品更具安全性 。