SCIG具有耐受性好、不良反应发生率低、易于患者自我管理等优点。SCIG(皮下注射免疫球蛋白)是由成千上万健康献血者的混合血浆制备而成的免疫球蛋白类血液制品药物,其主要成分是IgG。免疫球蛋白替代治疗是原发性免疫缺陷病的标准治疗方法,由于IMIG会引起注射部位疼痛明显且不良反应大,使得 IVIG和SCIG成为免疫球蛋白替代治疗的主要药物。其中SCIG因其具有耐受性好、不良反应发生率低、经济成本低、患者满意度较高、可维持稳定的生理水平的血清IgG浓度、可自我给药、易于患者自我管理等优点,近年来被广泛用于多种免疫性疾病的治疗。
海外已有多款SCIG产品上市,我国产品有待开发。2002年12月,CSL公司的Vivaglobin首先在德国获批,成为第一个专供于皮下注射用的免疫球蛋白,并在2006年1月获得FDA的认证许可。此后不同浓度、不同规格的SCIG陆续出现,如CSL公司的Hizentra、Shire公司的CuvitAK`ru等。与此同时,添加了不同辅助成分的SCIG药物也迅速发展,如促进型皮下注射免疫球蛋白(fSCIG)便是其中之一。fSCIG的主要优势是利用透明质酸酶可以暂时或局部地分解透明质酸的作用,加快药物通过皮肤细胞外基质,并帮助药物进人淋巴管,有利于大分子物质,主要是免疫球蛋白的吸收,可延长免疫球蛋白的输注间隔并提高耐受性,为免疫球蛋白的治疗方案提供更加广泛的选择。相比之下,我国血液制品企业暂无SCIG的生产,国内医务人员对SCIG的临床应用也知之甚少。

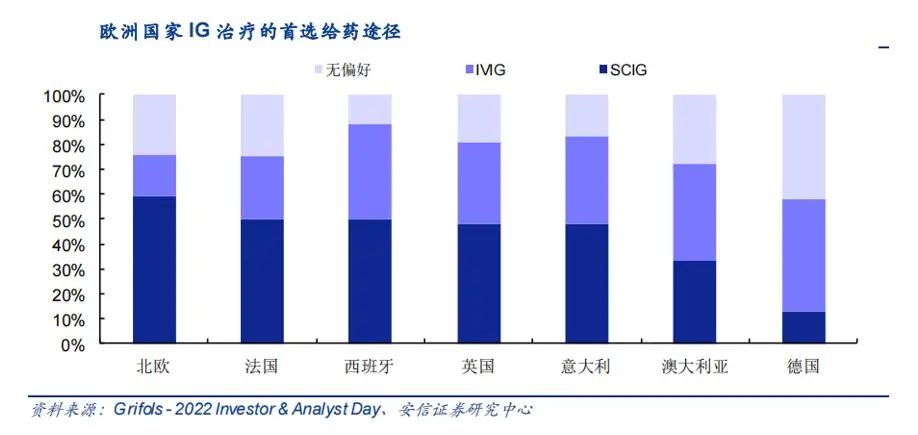
部分欧洲国家在IG治疗的给药方式上更偏好SCIG。根据基立福投资者交流材料,部分欧洲国家在IG治疗首选给药途径的偏好上,对SCIG的偏好已经超过了IVIG,例如北欧、法国、西班牙、英国及意大利对SCIG的偏好都已经超过 40%且高于对IVIG的偏好,澳大利亚和德国虽然在给药途径的选择上选择IVIG 的占比更高,但SCIG也已经占据了一部分市场份额,可见国外SCIG的临床应用已经日趋成熟,逐渐展现出可在家使用、可自我管理、副作用低、可更加稳定地维持生理水平的IgG浓度等IVIG所不具备的优点,被越来越广泛地接受。
天坛生物的SCIG已进入Ⅲ期临床试验。2015年,成都蓉生在国内首家启动 20%蛋白浓度SCIG产品的研发,并于2021年3月在国内首家获批开展临床研究。成都蓉生研发的该产品采用目前国际最先进的20%蛋白浓度配方,高浓度可以最大程度减少患者的皮下输注体积,缩短输注时间,减少副作用。目前国内尚无同类产品上市,若该产品后续顺利上市则意味着数万名原发性免疫缺陷病(PID)患者有望在未来几年内改变“月供式住院”的用药方式,在家中就可以完成输注,这将极大节约患者时间,更好地保障治疗,提高患者生存质量。